一、教學目標
1、知識與技能
了解常見化學反應中的質量關系;
理解質量守恒定律守恒的原因;
2、過程與方法
通過實驗操作及演示,培養學生對于實驗的觀察能力;
學生通過描述現象,比較反應前后物質質量關系,培養學生的實驗總結與分析能力;
3、情感態度與價值觀
通過實驗探究,培養學生嚴謹求實的科學態度;
通過實驗讓學生樂于探索,提升學習興趣。
二、教學重點及難點
1、教學重點
理解質量守恒定律;
2、教學難點
微觀現象理解質量守恒定律。
三、教學準備
托盤天平、紅磷、玻璃管(帶小氣球)、錐形瓶、酒精燈、火柴、鎂條、砂紙、坩堝鉗、砝碼、石棉網、藥匙、細沙、單孔橡皮塞、AR實驗軟件及設備
四、AR實驗教學優勢
1、質量守恒定律中測量托盤天平刻度小,演示時不宜觀察,AR通過放大鏡展示刻度數字,便于學生記錄實驗數據。
2、虛擬實驗教學器材及藥品,節省資源損耗,教師可以多次演示實驗。
3、課本上的質量守恒定律實驗由多個實驗驗證,AR實驗軟件平臺包含多個實驗,教師無需攜帶眾多實驗設備教學,方便教師在課堂上進行延伸知識講解。
4、紅磷燃燒時產生白煙,煙有毒,若實驗裝置氣密性檢測不足危害學生健康,AR實驗有效避免實驗中的危險。

五、教學過程
1、新課引入
【教師】我們都知道,在一定條件下,反應物發生化學反應生成新的物質,如前面課程學習的高錳酸鉀制取氧氣實驗,高錳酸鉀加熱生成錳酸鉀、二氧化錳、水,水電解產生氫氣和氧氣。那么反應物與生成物之間有什么樣的關系呢?我們今天就通過實驗來驗證一下。
2、實驗教學
【實驗探究1】紅磷燃燒實驗
(1)在底部放有細沙的錐形瓶中,放入一小堆干燥的紅磷;

(2)將一個玻璃管上端牢系小氣球插入到橡膠塞中,塞入錐形瓶的瓶口,玻璃管能夠接觸到紅磷;

(3)將錐形瓶和玻璃管整套裝置放置在托盤天平上,用砝碼進行質量測量,請同學們記錄數據,本次質量為114.9g;

(4)取下錐形瓶,點燃酒精燈,將橡膠塞上的玻璃管放置到酒精燈上加熱至灼燒紅熱后,迅速用橡膠塞塞進錐形瓶,觀察實驗現象。【現象】燃燒時產生白煙,氣球鼓起。

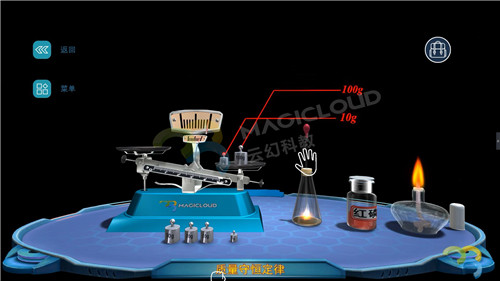

(5)待錐形瓶冷卻之后,重新放回到托盤天平上,并記錄實驗數據。

【結論】反應前實驗記錄質量為114.9g,實驗后反應記錄質量為114.9g,即反應前的各物質質量總和等于反應后的各物質質量總和。
【教師】大家是否懷疑是巧合呢?我們通過書本上93頁鐵釘與硫酸銅的實驗再來驗證一下,請看視頻。http://www.iqiyi.com/w_19ru1xwq3p.html
【總結】由以上實驗可見:參加化學反應的各物質的質量總和,等于反應后生成的各物質的質量總和。
【實驗探究2】鎂條燃燒實驗
【教師】那么是不是所有的化學反應都遵循質量守恒呢?接下來我們通過鎂條燃燒實驗來看一下
(1)使用砂紙打磨干凈一根鎂條,將它和一個石棉網一同放置在托盤天平上稱量,記錄實驗數據,質量為36.1g。


(2)點燃酒精燈,使用坩堝鉗夾住鎂條點燃后,迅速放回石棉網上,觀察現象并記錄實驗數據。【現象】指針偏向左方,質量為36.9g,增加0.8g。
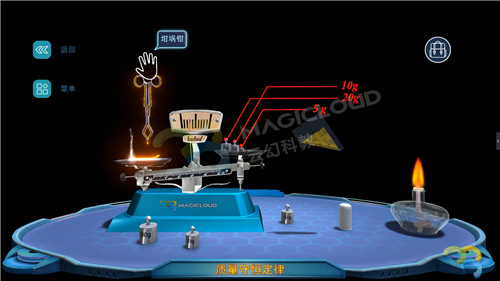
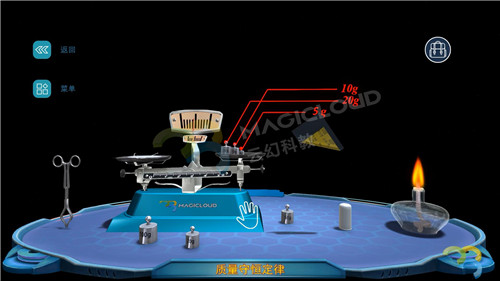
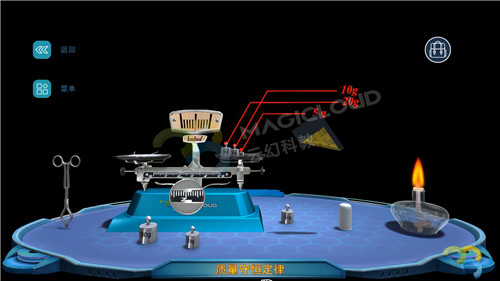
【教師】我們會發現托盤天平指針偏左,這是為什么呢?
【分析】Mg+O2==MgO2(條件:燃燒),天平之所以傾斜,是應為生成物質增加了反應中消耗的氧氣質量。
【教師】同樣的再通過另一個實驗《鹽酸與碳酸鈉粉末反應》驗證一下是否是這樣,請看視頻:http://www.iqiyi.com/w_19rta4jcmd.html
我們可以看到天平向左側傾斜, NaHCO3+HCl==NaCl+H2O+CO2,所以天平傾斜是因為釋放了CO2逸散到空氣中了。
【總結】由此說明,化學反應中遵循質量守恒定律。同時探究質量守恒定律必須在密閉體系中進行,防止反應時與外界物質發生交換。
3、實驗總結
參加化學反應的各物質的質量總和,等于反應后生成的各物質的質量總和。
且探究質量守恒定律必須在密閉體系中進行,防止反應時與外界物質發生交換。
4、結論分析
為什么物質在發生化學反應前后,各物質的質量總和相等?
這是因為化學反應的過程,就是參加反應的各物質(反應物)的原子重新組合而生成其他物質(生成物)的過程。在化學反應中,反應前后原子的種類沒有改變,數目沒有增減,原子的質量也沒有改變。如H2+O2==2H2O。
六、板書設計
質量守恒定律
1、紅磷燃燒實驗、鐵釘與硫酸銅實驗:
參加化學反應的各物質的質量總和,等于反應后生成的各物質的質量總和。
2、鎂條燃燒實驗、鹽酸與碳酸鈉粉末反應:
探究質量守恒定律必須在密閉體系中進行,防止反應時與外界物質發生交換。
3、質量守恒的微觀本質:
原子種類沒有改變、原子數目沒有增減、原子質量沒有變化