幾種重要的金屬化合物
【VR教學目標】
知識與技能目標:
1.了解鈉的氧化物的物理化學性質;
2.認識金屬氧化物的主要性質;認識碳酸鈉和碳酸氫鈉的不同點。
【過程與方法】
1.培養學生的觀察能力;訓練學生運用對比的方法認識事物和全面地分析事物的邏輯思維能力;完善學生的實驗能力和創造思維能力。
2.嘗試用分類方法學習物質的性質。
【教學重點與難點】
重點:鈉的氧化物的性質
難點:碳酸鈉和碳酸氫鈉的比較
【VR教學過程】
1.氧化鈉和過氧化鈉
復習:金屬單質的化學性質:與氧氣反應、與水反應、與堿反應。
導入:氧化鋁、氫氧化鋁、鋁鹽都含鋁元素,但因組成不同而性質不同;氧化鈉、氧化鋁、氧化銅、氧化鐵雖然都是氧化物,但由于所含的金屬元素不同,性質不同。不同類型的金屬化合物性質也不同。今節課我們研究幾種重要的金屬化合物。
思考交流:指導學生閱讀課本相關內容,并思考課本里面提出的兩個問題。
歸納整理:1、氧化納是白色固體,而過氧化納是淡黃色固體。
2、Na2O+H2O=2NaOH
實驗探究:由學生演示課本實驗3-5,指導學生觀察并記錄實驗現象。
歸納整理:現象——滴入水后有大量氣泡產生;氣體使帶有火星的木條復燃;試管外壁發熱;向溶液滴入酚酞后,溶液顏色變紅。
化學方程式:2Na2O2+2H2O=4NaOH+O2↑
過氧化納的用途:常作強氧化劑,用于漂白織物、麥稈、羽毛。
推進新課:過氧化鈉還能與二氧化碳反應:2Na2O2 + 2CO2 = 2Na2CO3 + O2;所以常用作呼吸面具上和潛艇里的供氧劑。
練習:寫出過氧化鈉與鹽酸反應的化學方程式:2Na2O2+4HCl = 4NaCl+2H2O +O2↑
問:過氧化鈉是堿性氧化物嗎?
歸納:不是。因為過氧化鈉與酸反應,除了生成鹽和水外,還生成氧氣。
投影:氧化鈉和過氧化鈉的比較
2.碳酸鈉和碳酸氫鈉
播放VR教學視頻(高中化學-無機化學-金屬碳酸鹽與酸的反應),了解碳酸鈉與酸的反應。
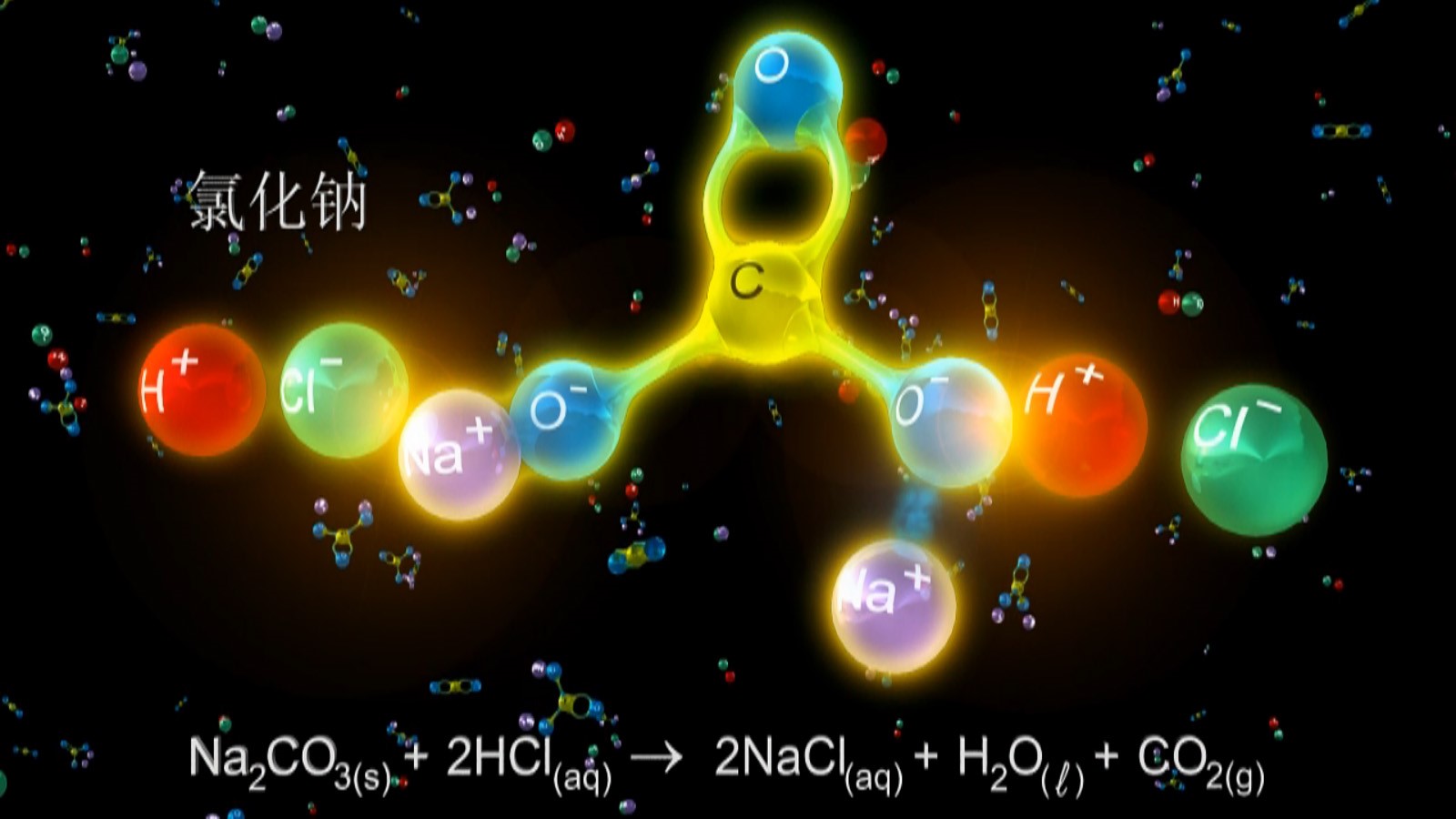

問:在面粉發酵或油條制作時常常用到純堿或小蘇打,你知道純堿、小蘇打的成分是什么嗎? 它們的化學性質有什么區別?
實驗探究:指導學生完成課本P56科學探究實驗:1、Na2CO3、NaHCO3在水中的溶解性實驗;2、Na2CO3、Na2CO3的熱穩定性;3、補充實驗——Na2CO3、NaHCO3分別與稀鹽酸、石灰水、CaCl2的反應。觀察并記錄實驗現象。
應用實踐:
(1)如何鑒別Na2CO3、NaHCO3兩種固體?如果是溶液,又如何鑒別?
(2)在Na2CO3中混有NaHCO3,如何除去?在NaHCO3中混有Na2CO3又如何除去?
(3)用途:Na2CO3用于制玻璃、肥皂、造紙和紡織等;NaHCO3則用作發酵劑、滅火劑和制藥等。
歸納整理:
Na2CO3 | NaHCO3 | |
俗名 | 純堿 蘇打 | 小蘇打 |
顏色狀態 | 白色固體 | 白色固體 |
溶解性 | 都能溶解于水,但 Na2CO3的溶解度大于NaHCO3的溶解度 | |
用途 | 制玻璃、造紙、制肥皂、紡織工業 | 發酵粉的主要成分、治療胃酸過多、泡沫滅火 |
與鹽酸反應 | Na2CO3+2HCl=2NaCl+CO2+H2O 若逐滴滴加鹽酸反應先后順序為: Na2CO3+HCl=NaCl+NaHCO3 NaHCO3+HCl=NaCl+CO2+H2O | NaHCO3+HCl=NaCl+CO2+H2O NaHCO3與鹽酸反應的劇烈程度大于Na2CO3與鹽酸反應的劇烈程度 |
與NaOH溶液反應 | 不反應 | NaHCO3+NaOH=Na2CO3+H2O |
與Ca(OH)2溶液反應 | 產生白色沉淀 Na2CO3+Ca(OH)2=CaCO3+2NaOH | 產生白色沉淀 2NaHCO3+Ca(OH)2=CaCO3+Na2CO3+2H2O |
與CaCl2溶液反應 | 產生白色沉淀 Na2CO3+CaCl2=CaCO3+2NaCl | 不反應 |
與CO2反應
| Na2CO3+CO2+H2O=2NaHCO3 若向飽和的Na2CO3溶液中通入CO2氣體,溶液中析出白色固體,因為NaHCO3的溶解度小于Na2CO3的溶解 | 不反應 |
熱穩定性 | 穩定,受熱不分解 | 2NaHCO3====Na2CO3+CO2+H2O |
3.焰色反應
問:大家知道節日燃放的五彩繽紛的煙花是怎么來的嗎?
講述:很多金屬或它們的化合物在灼燒時都會使火焰呈現特殊的顏色,這在化學上叫做焰色反應。
播放視頻:[實驗3—6]
小結:節日燃放的五彩繽紛的煙花,就是堿金屬,以及鍶、鋇等金屬化合物所呈現的各種艷麗的色彩。所以焰色反應常用于鑒別物質。