化學鍵
【VR教學目標】
知識目標:
1. 使學生理解共價鍵的概念,初步掌握共價鍵的形成,加深對電子配對法的理解;
2. 能較為熟練地用電子式表示共價分子的形成過程和分子結構;
3. 理解極性鍵、非極性鍵、化學鍵的概念。
【教學重點與難點】
重點:氨共價鍵和共價化合物的概念;用電子式表示共價化合物的形成過程。
難點:用電子式表示共化合物的形成過程;極性鍵與非極性鍵的判斷。
【VR教學過程】
一、課堂導入
上節課我們介紹了化學鍵中的離子鍵,本節課我們再來認識另一種類型的化學鍵—共價鍵。
二、講授新課
什么是共價鍵呢?我們初中所學的共價化合物的知識可以幫助我們找到答案。
請大家看以下實驗,并描述實驗現象
[多媒體課件演示]
氫氣在盛有氯氣的集氣瓶中燃燒。
【板書】H2+Cl2====2HCl
【板書】 原子之間通過共用電子對所形成的相互作用,叫做共價鍵。
【老師】氫原子與氯原子結合成氯化氫分子的過程,我們可用下列動畫形象地表示出來。
【老師】從氯原子和氫原子的結構來分析,由于氯和氫都是非金屬元素,不僅氯原子易得一個電子形成最外層8個電子的穩定結構,而且氫原子也易獲得一個電子,形成最外層兩個電子的穩定結構。這兩種元素的原子獲得電子難易的程度相差不大,所以相遇時都未能把對方的電子奪取過來。這兩種元素的原子相互作用的結果是雙方各以最外層一個電子組成一個電子對,電子對為兩個原子所共用,在兩個原子核外的空間運動,從而使雙方最外層都達到穩定結構。這種電子對,就是共用電子對。共用電子對受兩個核的共同吸引,使兩個原子結合在一起。在氯化氫分子里,由于氯原子對于電子對的吸引力比氫原子的稍強一些,所以電子對偏向氯原子一方。因此,氯原子一方略顯負電性,氫原子一方略顯正電性,但作為分子整體仍呈電中性。以上過程也可以用電子式表示如下:
【板書】
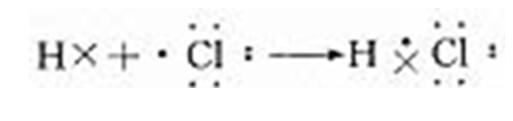
【老師】為什么用電子式表示離子化合物與表示共價化合物有如此區別呢?這是因為在氯化氫分子中,共用電子對僅發生偏移,沒有發生電子得失,未形成陰、陽離子,因此,書寫共價化合物的電子式不能標電荷。而氯化鈉形成過程中鈉原子完全失去電子給氯原子形成鈉離子和氯離子。因此兩者電子式的表示是不同的,同學們要注意這點區別。
[多媒體展示]練習:用電子式表示下列共價化合物的形成過程。CO2、NH3、CH4
學生活動,教師巡視,并讓三個同學到黑板上各寫一個:
【板書】
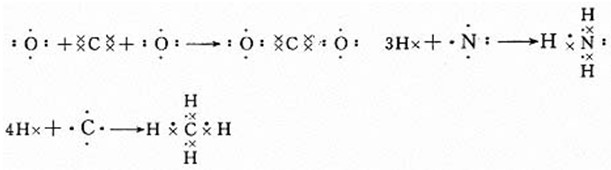
過渡:由以上分析可以知道,通過共用電子對可形成化合物的分子,那么,通過共用電子對,能不能形成單質的分子呢?下面,我們以氫分子為例,來討論這個問題。
【老師】請大家用電子式表示氯氣、氧氣、氮氣。
學生活動,教師巡視:對具有典型錯誤的寫法進行分析、評價:
【板書】
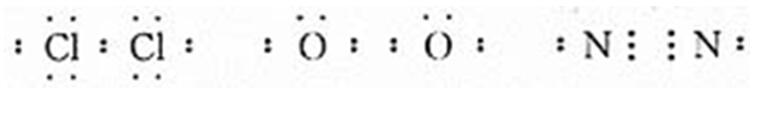
【老師】由此,我們得出以下結論:即同種或不同種非金屬元素化合時,它們的原子之間都能通過共用電子對形成共價鍵(稀有氣體除外)。
過渡:在化學上,我們常用一根短線來表示一對共用電子,這樣得到的式子又叫結構式。以上提到的幾種粒子,表示成結構式分別為:
【板書】
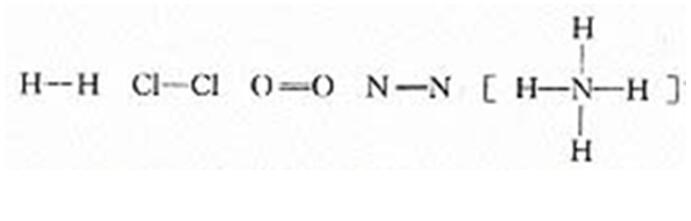
【老師】如果共價鍵中成鍵原子吸引電子的能力不同,共用電子對就偏向吸引電子能力強的原子,偏離吸引電子能力較弱的原子,使得共價鍵中正電荷重心和負電荷重心不相重合。鍵顯極性。同種原子形成共價鍵,共用電子對不發生偏移,這樣的共價鍵稱為非極性鍵;不同種原子形成共價鍵,共用電子對偏向吸引電子能力強的一方,這樣的共價鍵稱為極性鍵。
播放VR教學視頻(高中化學——物理化學——共價鍵)
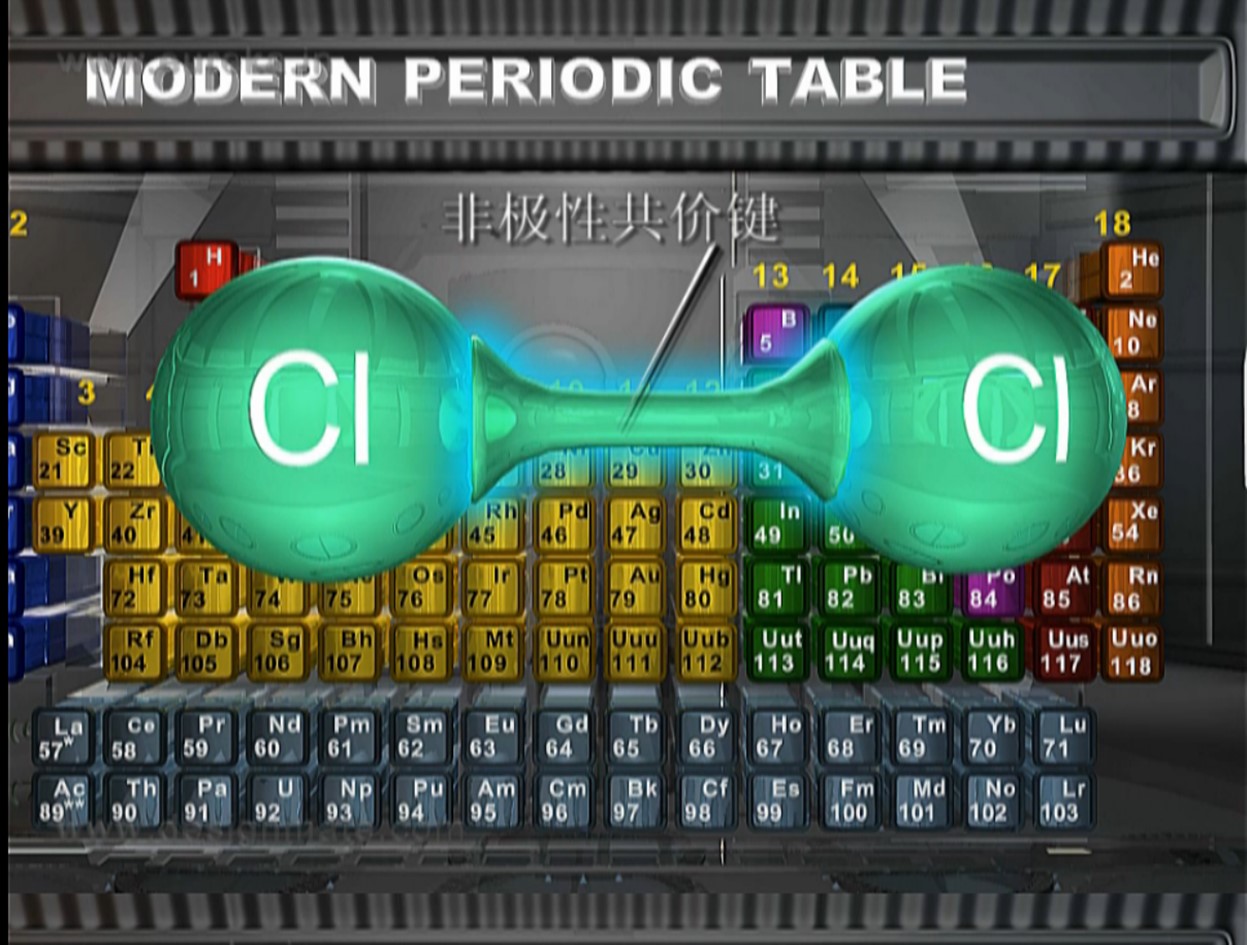
過渡:從有關離子鍵和共價鍵的討論中,我們可以看到,原子結合成分子時,原子之間存在著相互作用。這種作用不僅存在于直接相鄰的原子之間,而且也存在于分子內非直接相鄰的原子之間。前一種相互作用比較強烈,破壞它要消耗比較大的能量,是使原子互相聯結成分子的主要因素。我們把這種相鄰的原子之間強烈的相互作用叫做化學鍵。
【板書】三、化學鍵:相鄰的原子之間強烈的相互作用叫做化學鍵。
【板書】一個化學反應的過程,本質上就是舊化學鍵斷裂和新化學鍵形成的過程。
【老師】請大家用化學鍵的觀點來分析,H2分子與Cl2分子作用生成HCl分子的過程。
【學生】先是H2分子與Cl2分子中的H—H鍵、Cl—Cl鍵被破壞,分別生成氯原子和氫原子,然后氯原子與氫原子又以新的共價鍵結合成氯化氫分子。
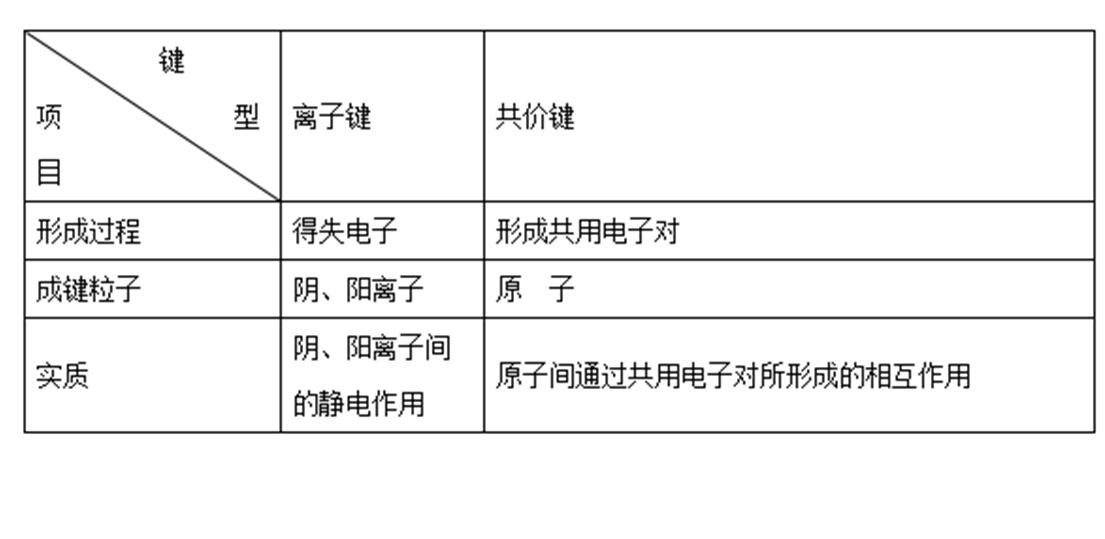
【老師】大家理解得很好。離子鍵和共價鍵是兩種不同類型的化學鍵,現在播放一段VR教學視頻(高中化學——物理化學——化學鍵合),請將它們之間的區別做出總結。
三、布置作業
書本習題