氨
【VR教學(xué)目標(biāo)】
知識目標(biāo):
1.認(rèn)識氨的物理性質(zhì)和用途,掌握氨和銨鹽的主要化學(xué)性質(zhì);
2.理解“噴泉”實驗中噴泉產(chǎn)生的原理;
3.能夠應(yīng)用所學(xué)基本知識和化學(xué)基本技能去檢驗銨離子;
4.了解氨的用途及氮元素在自然界中的存在。
技能目標(biāo):
1.學(xué)生通過收集、整理及加工資料,初步學(xué)會科學(xué)探究的一般方法,并進(jìn)一步掌握獲取課本以外化學(xué)信息的技巧;
2.學(xué)生通過對實驗的觀察和分析,加強觀察能力、思維能力和應(yīng)用化學(xué)實驗發(fā)現(xiàn)學(xué)習(xí)新知識的能力;
情感目標(biāo):
有效的教學(xué)必須確保學(xué)習(xí)主體的參與,使課程變?yōu)閷W(xué)生“自己的課程”,喚起學(xué)生自我需求,引發(fā)學(xué)生求知的興趣,產(chǎn)生愉快學(xué)習(xí)的心理體驗。學(xué)生通過對氨的學(xué)習(xí),可以增強環(huán)保意識、關(guān)注社會的意識和社會責(zé)任感,并且學(xué)生通過一系列的實驗操作,學(xué)生可以養(yǎng)成嚴(yán)謹(jǐn)?shù)目茖W(xué)態(tài)度及主動參與交流、團(tuán)隊合作的精神。
【教學(xué)重點與難點】
重點:氨的物理性質(zhì)、化學(xué)性質(zhì)及銨鹽的化學(xué)性質(zhì)
難點:對“噴泉”實驗的理解;氨氣的實驗室制法
【VR教學(xué)過程】
一、課堂導(dǎo)入
諾貝爾化學(xué)獎與合成氨有關(guān),而合成氨是人類發(fā)展史上的一項重大突破,解決了因糧食不足而導(dǎo)致的饑餓和死亡問題。既然氨那么重要,今天我們就共同來學(xué)習(xí)有關(guān)氨的物理性質(zhì)。
二、講授新課
1.氨的物理性質(zhì)
展示一瓶氨氣,請學(xué)生觀察其顏色、狀態(tài)、氣味、密度。
【實驗】完成實驗4-8(噴泉實驗)
【思考討論】
(1)燒瓶里為什么會形成噴泉?
(2)膠頭滴管的作用是什么?
(3)燒瓶中的溶液為什么變成紅色?
【歸納原因】
(1)燒瓶內(nèi)外產(chǎn)生壓強差。
(2)引發(fā)“噴泉”實驗。
(3)水溶液呈堿性,有OH-離子存在
【總結(jié)】
(1)實驗原理:利用氣體極易被一種液體吸收而形成壓強差,使氣體容器內(nèi)壓強降低,外界大氣壓把液體壓入氣體容器內(nèi),在玻璃導(dǎo)管尖嘴外形成美麗的“噴泉”。
(2)實驗現(xiàn)象:燒杯里的水由玻璃管進(jìn)入燒瓶,形成噴泉,燒瓶內(nèi)的液體呈紅色。
(3)結(jié)論:氨極易溶于水,且水溶液呈堿性。無色、有刺激性氣味的氣體,密度比空氣小,極易溶于水(1︰700)。易液化。
2.氨的化學(xué)性質(zhì)
【講授新課】
(1)與水的反應(yīng):
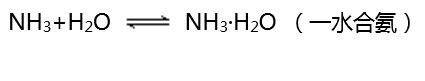
其中的NH3·H2O很不穩(wěn)定,受熱易分解為NH3和H2O
【思考討論】氨水顯堿性的原因是什么?
NH3·H2O可以部分電離形成NH4+和OH-,所以氨水顯弱堿性。
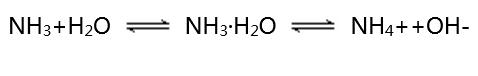
(2)氨與氧氣反應(yīng):

【探究實驗】濃氨水與濃鹽酸反應(yīng)
(3)與酸的反應(yīng)
NH3+HCl= NH4Cl(白煙)氨與揮發(fā)性酸反應(yīng)放出白煙
【練習(xí)】試分析如何檢驗氨氣?寫出氨氣與硫酸、硝酸反應(yīng)的化學(xué)方程式
(4)銨鹽
【過渡】氨氣與酸反應(yīng)生成的鹽叫銨鹽。那么銨鹽的性質(zhì)有那些呢?
【指導(dǎo)閱讀】閱讀教材P98:總結(jié)銨鹽的性質(zhì)
【歸納整理】
物理性質(zhì):白色固體或白色晶體,易溶于水。
化學(xué)性質(zhì):
①熱不穩(wěn)定性:
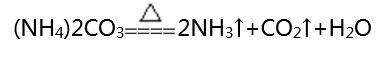
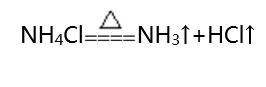
②遇堿性物質(zhì)有氨氣放出: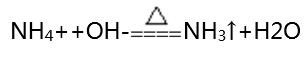
【自學(xué)歸納】工業(yè)制硝酸:

2NO+O2===2NO2; 3NO2+H2O=====2HNO3+NO
(5)氨與氧氣的反應(yīng):4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
【板書】氨的用途:制冷劑、制尿素、制硝酸、制純堿等
3.氨氣制法:
(1)工業(yè)制法:

(2)氨氣的實驗室制法:
播放VR教學(xué)視頻(高中化學(xué)-無機(jī)化學(xué)-氨氣的實驗室制法),視頻介紹了兩種氨氣的實驗室制法,先播放第一種制法:銨鹽與堿加熱制取,配合視頻演示做以下講解:
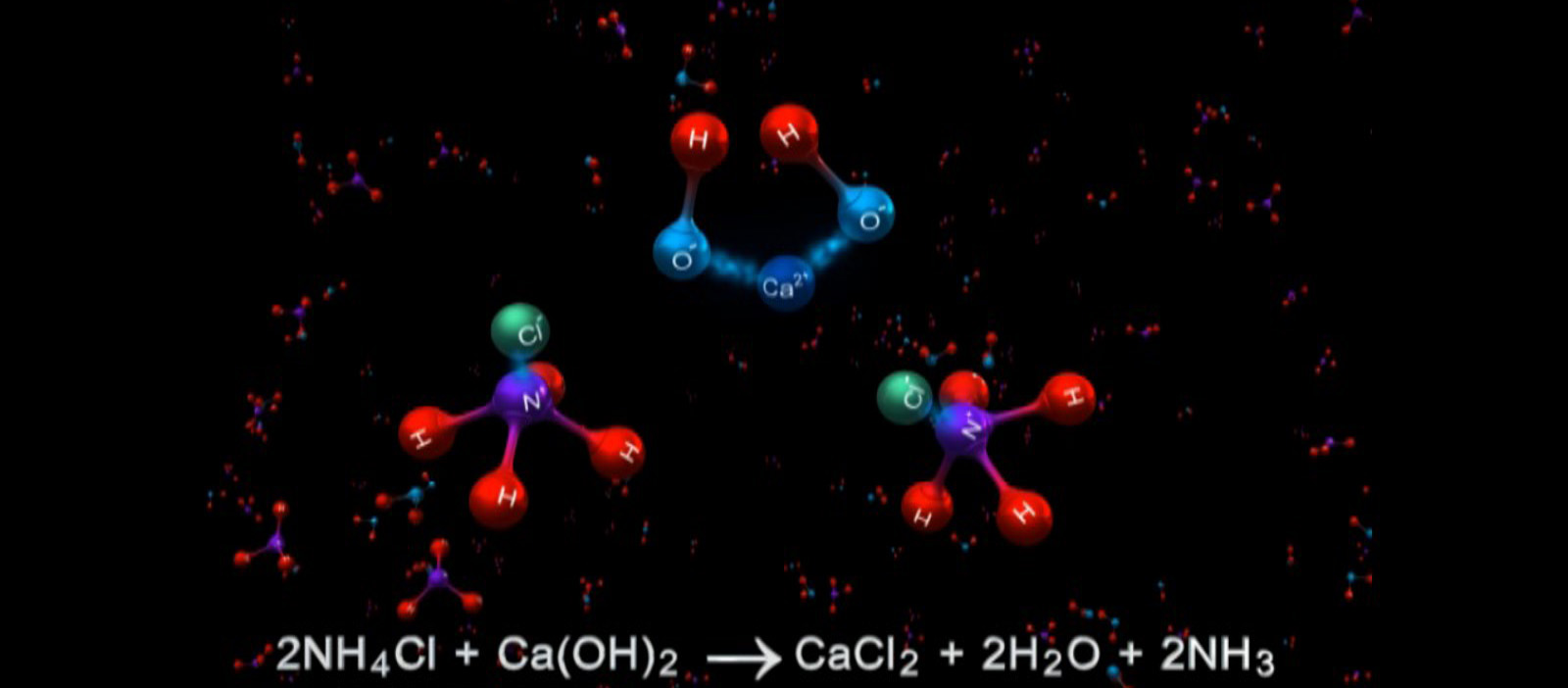
①原料:NH4Cl與Ca(OH)2
②條件:混合加熱
③原理:
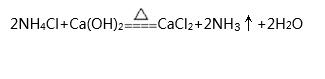
制取裝置:固+固加熱裝置 (試管向下傾斜)
收集裝置:向下排空氣法(棉花的作用:防止空氣對流)
驗滿:a:濕潤的紅色石蕊試紙變藍(lán)(唯一的一種堿性氣體)
b:蘸有濃HCl的玻璃棒接近試管口產(chǎn)生白煙。
尾氣處理: 濃硫酸吸收多余的氨氣。
干燥裝置: 用堿石灰干燥。
【自主學(xué)習(xí)課外閱讀】
1. 氨氣的第二種制法:金屬氮化物與熱水反應(yīng)制取(播放VR教學(xué)視頻:高中化學(xué)-無機(jī)化學(xué)-氨氣的實驗室制法)
2. 氨的用途和自然界中氮的循環(huán)
(1)氮是蛋白質(zhì)的基本組成元素之一。所有生物體內(nèi)均含有蛋白質(zhì),所以氮的循環(huán)涉及到生物圈的全部領(lǐng)域。
(2)氮是地球上極為豐富的一種元素,在大氣中約占79%。氮在空氣中含量雖高,卻不能為多數(shù)生物體所直接利用,必須通過固氮作用。
(3)固氮作用的兩條主要途徑,一是通過閃電等高能固氮,形成的氨和硝酸鹽,隨降水落到地面;二是生物固氮,如豆科植物根部的根瘤菌可使氮氣轉(zhuǎn)變?yōu)橄跛猁}等。植物從土壤中吸收銨離子(銨肥)和硝酸鹽,并經(jīng)復(fù)雜的生物轉(zhuǎn)化形成各種氨基酸,然后由氨基酸合成蛋白質(zhì)。
(4)動物以植物為食而獲得氮并轉(zhuǎn)化為動物蛋白質(zhì)。動植物死亡后遺骸中的蛋白質(zhì)被微生物分解成銨離子(NH4+)、硝酸根離子(NO3-)和氨(NH3)又回到土壤和水體中,被植物再次吸收利用。
【小結(jié)】
本節(jié)課我們主要學(xué)習(xí)了氨的化學(xué)性質(zhì)及其制法,重點要掌握的是氨與水的反應(yīng)和氨氣實驗室制法的原理和裝置。
三、鞏固練習(xí)
例題1、下列關(guān)于氨性質(zhì)的敘述中正確的是( B)
A、氨氣可用排水法收集
B、氨水呈堿性
C、氨氣和酸相遇都能產(chǎn)生白煙
D、在反應(yīng)NH3+H+=NH4+中,氨失去電子被氧化
例題2、某同學(xué)在實驗室中發(fā)現(xiàn)了一瓶有刺激性氣味的氣體,根據(jù)氣體的判斷可能是氨氣,但不知是否確實是氨氣,下列提供的方法中,你認(rèn)為能幫他檢驗是否為氨氣的方法是( AC )
A、將濕潤的紅色石蕊試紙放在瓶口
B、將干燥的紅色石蕊試紙放在瓶口
C、用蘸有濃鹽酸的玻璃棒靠近瓶口
D、將濕潤的藍(lán)色石蕊試紙放在瓶口
四、布置作業(yè)
課本第2、4題