【VR教學目標】
1、知識與技能
(1)知道鐵、鋁、銅等常見金屬與氧氣的反應;
(2)初步認識常見金屬與酸的置換反應,能利用置換反應解釋一些與日常生活有關的化學問題。
2、過程與方法
(1)能進行探究金屬活動性強弱的實驗設計,學會控制實驗條件探究金屬活動性順序;
(2)學習和體驗對實驗現象進行比較、分析、概括并獲取結論的方法。
3、情感態度價值觀
(1)通過學生親自做探究實驗,激發學生學習化學的濃厚興趣;
(2)通過對實驗的探究、分析,培養學生嚴謹、認真、實事求是的科學態度;
(3)使學生在實驗探究中學會與別人交流、合作,增強協作精神。
【教學重點與難點】
重點:對金屬活動性順序的探究,歸納得出置換反應的特點
難點:金屬活動性順序和置換反應的理解和應用
【VR教學過程】
1. 場景引入(5分鐘)
【老師】展示金戒指,黃銅,播放2D視頻:不法分子以黃銅冒充黃金進行詐騙活動。
討論:人們為什么會上當?現請你設計一個實驗方案鑒別真假黃金。
【學生】交流后回答:比較硬度,硬度大的是黃金,硬度小的是黃銅;比較密度,密度大的是黃金,密度小的是黃銅;灼燒,變成黑的上黃銅,不變的是黃金。
【小結】前兩種方法利用的是金屬物理性質,后一種方法利用的是金屬的化學性質。
【過渡】要想更好的使用金屬,就需要了解金屬的各種性質。上節課我們學習了金屬的物理性質,本節課我們來學習金屬的化學性質。
2. 新課教學(20分鐘)
(1)金屬與氧氣的反應
【老師】常溫能反應:以鎂、鋁為代表;高溫下能反應:以鐵、銅為代表;高溫下也不能反應:以金為代表。
播放VR教學視頻,了解各種金屬與氧氣的反應(初中化學-無機化學-金屬與氧的反應)
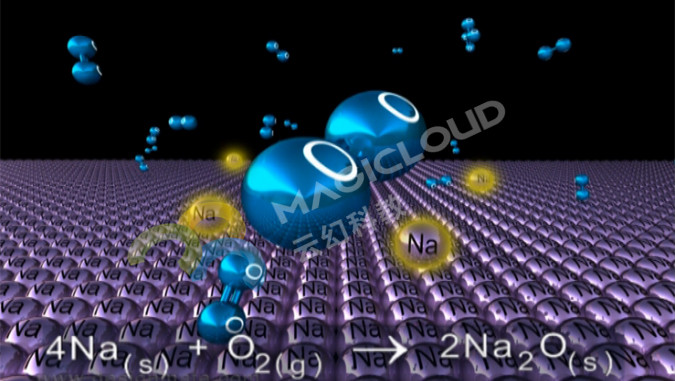
【學生】比較鎂、鋁、鐵、銅、金的活潑程度差異:鎂、鋁比較活潑,鐵、銅次之,金最不活潑。
【老師】鋁的化學性質很活潑,為什么通常鋁制品卻很耐腐蝕?
【老師】用砂紙打磨鋁條表面,觀察表面顏色變化。然后將鋁條在空氣中放置一會兒,再觀察表面顏色變化。巡視、指導學生實驗并提供幫助
【老師】①為什么鋁條在打磨前后或放置前后顏色會有變化?在打磨后鋁能接觸到什么物質而發生反應?②鋁在空氣中被氧化時分別生成氧化鋁,鋁為什么沒有繼續被氧化而一直腐蝕下去呢?
【學生】觀察、討論回答
【小結】鎂、鋁在常溫下就能與氧氣反應。如鋁在空氣中與氧氣反應,其表面生成一層致密的氧化鋁薄膜,從而阻止鋁進一步氧化,因此,鋁具有很好的抗腐蝕性能。
【老師】使用鋁制品應注意什么?
【學生】討論回答:不用硬物擦洗鋁制品,小心保護表面的氧化鋁薄膜。
(2)金屬與酸的反應
【學生】觀看VR教學視頻(初中化學-無機化學-金屬與酸的反應),結合課本圖8-12 金屬與鹽酸反應的比較

【小結】鎂、鋁、鋅、鐵、銅的金屬活動性由強到弱依次為鎂>鋁>鋅>鐵>銅
【老師】在鎂、鋅、鐵、銅幾種金屬中,哪些金屬能與稀鹽酸、稀硫發生反應?由此你能把金屬分為哪兩類?
【學生】可分能與酸發生反應的金屬和不能與酸發生反應的金屬這兩類。
【老師】分析鎂、鋅、鐵與鹽酸的反應方程式
Mg + 2HCl ——— MgCl2 + H2↑
Zn + 2HCl ——— ZnCl2 + H2↑
Fe + 2HCl ——— FeCl2 + H2↑
請大家從反應物和生成物的物質類別如單質、化合物的角度分析,這些反應有什么特點?它與我們學過的化合反應和分解反應的特點是否相同?
【學生】特點:(單質)+(化合物)=(化合物)+(單質),即由一種單質跟一種化合物反應生成另一種單質和另一種化合物,其特點不同于化合反應和分解反應。
【老師】由一種單質跟一種化合物反應生成另一種單質和另一種化合物的反應叫做置換反應。置換反應的通式如何書寫?
【學生】A + BC = B + AC
3、課后練習:完成書本的表格