一、VR教學目標
1、知識與技能
(1)了解物質的量及其單位,了解物質的量與微觀粒子數之間的關系;
(2)通過對1 mol物質質量的討論,理解摩爾質量的概念以及摩爾質量和相對原子質量、相對分子質量之間的關系。
2、過程與方法
(1)通過對物質的量概念的理解,嘗試從定量的角度去認識物質,體會定量研究方法對研究和學習化學的重要作用;
(2)經歷物質的量與微觀粒子數、物質的質量之間的換算,理解概念、運用和鞏固概念,提高化學計算能力。
3、情感態度與價值觀
在物質的量概念的建構過程中感受到微觀和宏觀的相互轉化是研究化學的科學方法之一。
二、教學重點與難點
1、教學重點
(1)物質的量及其單位、阿伏加德羅常數;
(2)摩爾質量概念和有關摩爾質量的計算。
2、教學難點
(1)物質的量概念的教學;
(2)摩爾質量、氣體摩爾體積概念的建立。
三、VR教學過程
【教師】大家都知道曹沖稱象的故事,那么,曹沖稱象的主要思想是什么呢?將巨大的不可直接稱重的大象“分解”成一塊塊可以稱重的石頭。這個故事給我們的啟示就是化整為零。日常生活中,買大米時我們一般論斤買而論“粒”就不方便,一斤就是許多“粒”的集合;買礦泉水我們可以論瓶買,但買多的也可以論箱買,一箱就是24瓶的集合等等。一滴水中就大約含有1.7萬億億個水分子,如果一個個去數,即使分秒不停,一個人窮其一生也無法完成這個工作。那我們怎樣才能既科學又方便地知道一定量水中含有多少個水分子呢?所以,這里需要一個“橋梁”,需要一個物理量把宏觀質量和微觀粒子數聯系起來,這個物理量就是“物質的量”。
第14屆國際計量大會通過以“物質的量”作為化學計量的基本單位量,至此,物質的量和長度、質量、時間等成為國際單位制中的7個基本單位。
物理量 | 單位名稱 | 單位符號 |
長度 | 米 | m |
質量 | 千克(公斤) | kg |
時間 | 秒 | S |
電流 | 安[培] | A |
熱力學溫度 | 開[爾文] | K |
物質的量 | 摩[爾] | mol |
發光強度 | 坎[德拉] | cd |
【學生】理解國際基本單位。
【教師】強調:1、物質的量表示物質所含微粒的多少,這四個字是一個整體,不得簡化或增添任何字,物質的量實際上表示含有一定數目粒子的集體。
2、物質的量是以微觀粒子為計量的對象,而這里的“粒子”是指構成物質的“基本單元”、這個基本單元可以是分子、原子、離子、中子、質子等單一粒子,也可以是這些粒子的特定組合。
3、物質的量用符號“n”表示。
觀看VR互動教學視頻-摩爾的概念,提問每種物理量都有相應的單位。速率的單位是“米/秒”,“物質的質量”的單位是“千克”等。“物質的量”作為一種物理量也應有相應的單位,它的單位是什么?科學上用“摩爾”作為“物質的量”的單位。1摩爾是多少?


【學生】在國際上摩爾這個單位是以0.012 kg 12C 中所含的原子數目為標準的,即1 mol粒子集體所含的粒子數與0.012 kg 12C 中所含的原子數相同,約為6.02 × 1023個。也就是說,如果在一定量的粒子集體中所含有的粒子數與12 g 12C中所含的碳原子數目相同,則它的物質的量為1 mol,而這個數值(粒子數)我們就叫它為阿伏加德羅常數。
【教師】已知:一個碳原子的質量為 1.993 × 10-23 g 求: 12 g 12C 中所含的碳原子數。
【學生】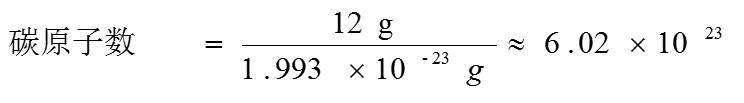
【教師】根據表中已知條件進行計算,將結果填入表中空格內:
物質微粒 | 物質質量 | 1個微粒實際質量 | 所含微粒數目 | 物質的量 |
12C | 12 g | 1.993 3 × 10-23 g | 6.02 × 1023 | 1 mol |
Fe | 56 g | 9.3 × 10-23 g | 6.02 × 1023 | 1 mol |
O2 | 32 g | 5.32 ×10-23 g | 6.02 × 1023 | 1 mol |
Na+ | 23 g | 3.82 × 10-23 g | 6.02 × 1023 | 1 mol |
觀看VR互動教學視頻-摩爾的概念,據表結合視頻可得出什么結論?


【學生】1 mol 任何粒子集合體都約為 6.02 × 1023 個粒子;而 1 mol 任何粒子或物質的質量以克為單位時,其數值都與該粒子的相對原子質量相等。
四、板書設計
第二節 化學計量在實驗中的應用
一、物質的量的單位——摩爾
1、物質的量是一個物理量,表示含有一定數目粒子的集合體。
注意:1. 是七個國際基本物理量之一。
2. 是一個專有名詞,由固定字數組成,不能分割、不能增減。
3. 符號為“n”。
4. 微粒是指:分子、原子、離子、電子、質子、原子團、中子等。
5. 粒子必須十分明確,且用化學式表示。
2、摩爾
(1)概念:是物質的量的單位,簡稱摩。
(2)符號:mol 。
3、阿伏伽德羅常數(NA):把1 mol任何粒子的粒子數叫做阿伏加德羅常數,數值為6.02×1023/mol。
4、物質的量、阿伏加德羅常數與粒子數( N )之間的關系:
n =N/NA
5、摩爾質量
(1)概念:單位物質的量的物質所具有的質量叫做摩爾質量。
(2)符號:M
(3)單位:g ? mol -1或 g / mol 。
(4)物質的量、質量和摩爾質量之間的關系:
n =m/M